
ד"ר עינת שדות
חוקרת במחלקה לצמחי נוי וביוטכנולוגיה, המכון למדעי הצמח, מכון וולקני

גל הדס ברנדווין
בוגרת תואר שני במעבדה של עינת שדות, מנהלת פעילות המו"פ במשתלת חסקלברג, כפר ויתקין.
תוכן עניינים
מבוא
ריבוי צמחים בטבע וכן בתעשייה החקלאית מתרחש בשתי דרכים. הראשונה, ריבוי מיני ויצירת זרעים. בשיטה זו מתקבלים צאצאים השונים גנטית מצמח האם המקורי והיא מאפשרת את יצירת המגוון הגנטי הגדול שיש בטבע, אולם בחקלאות, במקרים רבים, נדרשת אחידות. הדרך השנייה היא על ידי ריבוי וגטטיבי מרקמות שונות בצמח, תהליך בו נוצר העתק גנטי של צמח האם המקורי. ריבוי וגטטיבי הוא כלי אשר משמש את עולם החקלאות במשך שנים רבות ומהווה חלק חשוב בקידום התעשייה החקלאית ובתוך כך גם בתעשיית המזון. בשיטה זו בעצם ניתן ליצור עותקים של חומר צמחי בעל יתרונות משמעותיים כמו יבול, איכות פרי וכד'. ריבוי וגטטיבי מתבסס על יכולתו של צמח לעבור תהליך רגנרציה (חידוש אברים) בו תאים מתמיינים מחדש על מנת ליצור את האיברים החסרים ולמלא את הפונקציות החסרות. מבין השיטות המקובלות כיום לריבוי וגטטיבי ניתן למנות את ההשרשות, ריבוי מתרבית רקמה וכן את ההרכבות.
הרכבת צמחים היא שיטה מוכרת הקיימת שנים רבות. שיטה זו מאפשרת ליצר צמח אחד הנוצר משילוב של שני צמחים. מטרת השיטה היא לשפר את איכות הגידול ורמת היבול. מירב עצי הפרי הגדלים היום מורכבים ובשנים האחרונות החלה מגמה דומה גם בירקות (Bie et al., 2017). בתהליך ההרכבה משתמשים בשני חלקים: הרוכב אשר מהווה את הנצר, בדרך כלל יהיה הזן הרצוי למאכל או קישוט עם מדובר בצמח נוי או כל צמח בעל תכונות אחרות שנרצה לשמר. החלק השני הוא הכנה אשר תורמת את השורשים. כנות יכולות לספק תכונות המשרות עמידות למחלות קרקע ותנאי קיצון, להגביר את פוריות הזן ולהקנות יכולת התבססות טובה באדמה (Goldschmidt, 2014). לכן, השימוש בהרכבה מאפשר לבחור זני עילית ועל ידי הרכבתם על כנות נבחרות לשפר את עמידות הצמח לתנאי עקה שונים, לשפר את הצימוח והפוריות, ולקצר את הזמן עד להופעת פרי. יתרון משמעותי נוסף של שיטת ההרכבה היא היכולת להתגבר על מגבלת הריבוי של צמחים קשיי השתרשות, כמו למשל אבוקדו, אקליפטוס ועוד. בנוסף, באמצעות הרכבות, יכולים חקלאים להחליף זנים לא רצויים ולא רלוונטים בזנים חדשים שיצאו מתוכניות טיפוח ובכך לחסוך את הכרוך בהקמת מטע חדש בשטח.
הרכבת צמחים היא תהליך מורכב אשר הצלחתו מושפעת מגורמים רבים, במאמר זה נסקור את סוגי ההרכבות, את השלבים השונים בתהליך האיחוי והגורמים אשר משפיעים עליו , כמו כן נפרט מספר דוגמאות לשימוש בהרכבות בחקלאות וכן במחקר . המידע המפורט במאמר זה מתבסס על ידע שנאסף מהספרות לאורך השנים וכן על עבודות מחקר שבוצעו במעבדתנו ובמשתלת חסקלברג.
שיטות נפוצות להרכבה
ישנן מספר שיטות לבצע הרכבה. שיטת ההרכבה תבחר לרוב על פי סוג הצמח, גילו והעונה בשנה. בכולן המטרה היא בסופו של דבר לאפשר איחוי בין מערכת ההובלה של הרוכב לזו של הכנה. מערכת ההובלה של הצמח כוללת שלוש רקמות עיקריות: העצה, השיפה ורקמת הקמביום שבינהן אשר מהווה מקור לתאים בעלי כושר חלוקה. על מנת לקבל איחוי תקין יש ליצור מגע בין הקמביום של הכנה לזה של הרוכב בכל שיטות ההרכבה. לכן במהלך התהליך חשוב להקפיד על הידוק בין רקמות הכנה והרוכב וכן שמירה על לחות לאורך כל התהליך. שמירה על לחות יכולה להיעשות במספר דרכים , בינהן עטיפת אזור ההרכבה בפארפילם, סגירה באמצעות שקית או בקבוק אשר שומר על לחות, אחסון בתא לח או ציפוי בשעווה. בפרק זה יפורטו מספר שיטות הרכבה ברמה הבסיסית. להרחבה והעמקה בשיטות השונות מומלץ לפנות לספרים : "ריבוי עצי פרי" של רינה פרבר, ו- “Plant propagation-principles and practices” של Hartmann & Kester's.
הרכבת עין– שיטה המוכרת בעיקר במשתלות ובעצים בעלי גזע דק יחסית. בשיטה זו הרוכב הוא בעצם פקע אחד מהענף יחד עם פיסה מהקליפה, אותו מחברים לגזע הכנה (איור 1A). מהכנה מגלחים חלק קטן המתאים בגודלו לקטע שהוסר מהרוכב, או שמבצעים חתך בצורת T, מפרידים בעדינות את הקליפה ומחדירים לרווח את הרוכב. לאחר מכן מצמידים את שני החלקים אחד לשני ומהדקים. רצוי לבצע הרכבה זו כאשר הקליפה נפרדת בקלות מהגזע, בדרך כלל כאשר הצמח נמצא בצמיחה פעילה והקמביום פעיל. לעיתים הפקע יורכב כאשר הוא רדום ולעיתים דווקא במצבו הפעיל בתחילת עונת הצימוח. בפקע רדום, בנשירים מרכיבים ממש לפני הכניסה לתרדמה כאשר הקליפה עדין פעילה ונפרדת מהגזע, לבלוב של ענף חדש מהפקע תראה לאחר תקופת התרדמה. הרכבת פקע פעיל לעומת זאת תעשה באביב או בסתיו, במצב זה נראה לבלוב של הפקע מיד לאחר קליטת ההרכבה. בשני המצבים ישנה עדיפות לקחת את הפקע המורכב מענף צימוח של אותה השנה אשר התעצה מספיק. ישנן אפשרויות נוספות להרכבה מלבד הסרת אזור הפקע בלבד, ובהן משתמשים כאשר הרכבה כזו אינה מצליחה. אלו כוללות הרכבת טלאי , הרכבת חליל ועוד. שיטת ההרכבה וסוג הרוכב יבחרו בהתאם לצמח אותו רוצים להרכיב, ובהתאם לניסיון העבר. אם אין מידע קודם, ניתן לבדוק מספר שיטות.
הרכבות ראש – שיטה זו כוללת בתוכה מספר אפשרויות אשר בכולן המכנה המשותף הוא הורדת החלק העליון של צמח הכנה. במקרה זה הרוכב יהיה חלק שלם של ענף בעל מספר פקעים ( לרוב לא יותר מ 2-3). הרכבות ראש נפוצות במשתלות וכן במטעים כאשר מחליפים זנים בעצים בוגרים. קיימות אפשרויות רבות להרכבה מסוג זה, ולהלן נסקור את הנפוצות ביותר:
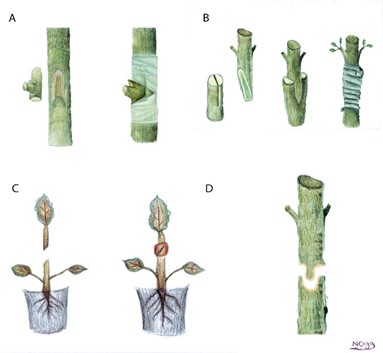
איור מס' 1 - שיטות נפוצות להרכבה
A הרכבת עין
B הרכבת יתד/V
C הרכבת אלכסון
D הרכבת אומגה.
ציורים מאת נגה חסקלברג
הרכבת סדק/יתד/V– ישנם מספר שמות לשיטה זו, והיא השיטה הנפוצה ביותר במשתלות ולרוב תעשה על ענפים דקים יחסית. במקרה זה חותכים את הרוכב משני הצדדים בצורת יתד בעל שני אלכסונים משופעים שווים בגודלם. את הכנה חותכים במרכז, פוערים מעט את הפתח שנוצר בגזע ואליו מחדירים את הרוכב. יש לעטוף ולהדק את אזור ההרכבה (איור 1B).
הרכבת חיבור פשוטה/הרכבת אלכסון – בשיטה זו הכנה והרוכב חייבים להיות שווים בעוביים. בראש הכנה יעשה חתך אלכסוני וחתך דומה יעשה בבסיס הרוכב. את שני החלקים מצמידים וכורכים יחד באמצעות סרט (איור 1C). שיטה זו היא השיטה הנפוצה ביותר בהרכבת ירקות. לצורך שיטה זו אף פותחו קליפסים בעוביים ומסוגים שונים אשר נועדו להחזיק את הכנה והרוכב יחד ולהקל על תהליך ההצמדה ביניהם. בשנים האחרונות החלה מגמה של הרכבת עצי פרי, ההרכבה נעשית במשתלות בזמן שהצמח צעיר ועשבוני והן מכונות הרכבות ירוקות. הרכבה זו לרוב לא נפוצה כאשר הצמח מעוצה בשל הקשיים הטכנים בקשירת הכנה לרוכב במצב זה. על מנת להתגבר על כך פותחה שיטה נוספת הנקראת "הרכבה אנגלית" , בה מבצעים סדק דק בעומק של מילימטרים אחדים אשר יוצר מעין לשון בשליש העליון של האלכסון, חתך דומה עושים גם בכנה ולאחר מכן מלבישים את שני חלק הצמח אחד על השני תוך הקפדה על חפיפה מלאה בינם.
הרכבת יתד אלכסונית- הרכבה זו מתאימה למקרים בהם הכנה עבה יותר באופן משמעותי מהרוכב. במקרה זה חותכים את הרוכב משני הצדדים בצורת יתד בעל שני אלכסונים משופעים, כאשר אורך האלכסונים אינו שווה. לרוב הצד בו תהיה העין העליונה יהיה 2-3 ס"מ והצד השני יהיה כמחצית מאורכו של הראשון. את הכנה יש לחתוך בחתך אלכסוני מהצד עד האמצע, פותחים את החתך ומכניסים את הרוכב כך שהצד הארוך יפנה לפנים הכנה.
הרכבת אומגה הייתה נפוצה בגפנים עד לתחילת עידן ההרכבות הירוקות. לשם ביצוע שיטה זו משתמשים בסכין מיוחדת החותכת צורה משלימה בכנה וברוכב בצורת אומגה (כמו חתיכות מתאימות בהרכבת פאזל) (איור 1D).

איור מס' 2- הרכבת כתר/ תחיבה. ציור נגה חסקלברג.
הרכבת כתר/ תחיבה – שיטה זו נפוצה בעיקר בעצים בוגרים, לרוב כאשר רוצים לבצע החלפת זן במטע. שיטה זו אפשרית רק כאשר הקמביום של כנה פעיל ביותר והקליפה שלה נפרדת בקלות מהגזע, בישראל לרוב מדובר בעונת האביב. לטובת כך, כורתים את הענף המיועד להרכבה, או את העץ כולו ומשאירים גדם של הגזע, תוך הקפדה על חיתוך חלק שלו. הרוכבים יהיו ענפים מעוצים בעלי 2-3 פקעים מפותחים אך עדין רדומים. בבסיס הרוכב יבוצע חתך אלכסוני משופע משני צדיו התחתונים בדומה להרכבת יתד. בכנה חותכים חתך עדין לאורך הקליפה משני הצדדים ובתוכו דוחפים את הרוכבים, יש להקפיד שעובי החתך של הכנה יהיה שווה פחות או יותר לעובי החתך שבוצע ברוכב. ניתן להכניס מספר רוכבים בשיטה זו מסביבו של הענף, על פי עוביו (איור 2). יש לשים לב שהורכב צמוד ומהודק היטב לשני הצדדים של הכנה (לקליפה ולחלק הפנימי), באמצעות קשירה בסרט הרכבה. כיוון שהרכבה זו מתבצעת לרוב בחוץ ולא בתנאים מבוקרים יש להקפיד על טיפול נכון. ראשית יש לכסות את ההרכבה בשקית אלומיניום על מנת שלא תיחשף לשמש ולאידוי, יש כאלו אשר עטופים כל רוכב בנוסף בפארפילם על מנת למנוע התייבשות. בנוסף את העץ הקטום רצוי להלבין, למשל עם חומר מסוג "שלגזע" (מבוסס סיד) בריכוז 25% על מנת להימנע ממכות שמש. ניתן בנוסף לרסס את אזור ההרכבה בקוטלי פטריות. לאחר ההרכבה יש לעקוב אחר ההתפתחות ובמידת הצורך לרסס שנית בקוטלי פטריות. לאחר שהפקעים מתחילים לפרוץ פותחים את שקית האלומיניום בהדרגה עד להסרה מלאה, על מנת למנוע חשיפה מהירה מידי לשמש.

איור מס' 3 – הרכבת קירוב . ציור נגה חסקלברג
הרכבת צד- בשיטה זו לא גוזמים את ראש הכנה אלא לאחר הצלחת איחוי ההרכבה. ברוכב חותכים חתכים אלכסונים משני צדיו, כאשר צד אחד ארוך יותר מהצד השני. בצד אחד של כנה עושים חתך באורך המתאים לזה שבוצע ברוכב ומחדירים אותו כך שצידו הארוך יפנה אל הגזע. כורכים את אזור החיבור כך שלא יישאר חשוף ואת הרוכב מכסים בשקית על מנת שישמור על לחות. לאחר שההרכבה נקלטת קוטמים את ראש הכנה (פעולה זאת נקראת גירדום.
הרכבת קירוב – בשיטה זו משתמשים למינים בהם שיטות ההרכבה הרגילות לרוב אינן מצליחות. במצב זה משאירים גם את הכנה וגם את הרוכב שלמים (מערכת השורשים והנוף) ויוצרים מגע בין הקמביום של הכנה לרוכב באמצעות הסרת חלק מהקליפה והידוק של הגזע של כל אחד מהחלקים אחד לשני. לאחר שהאיחוי הושלם, מנתקים את הרוכב משורשיו ואת הכנה מהנוף שלה. לרוב את שתילי הכנות מרבים במיכלים, כאשר הם מגיעים לעובי הרצוי מבצעים את ההרכבה לזן הרצוי שנמצא במטע (איור 3). ישנן צורות שונות לבצע הרכבה זו, פירוט ניתן למצוא בספרים שצוינו.
תהליך איחוי ההרכבה
במהלך תהליך ההרכבה, נוצרת פציעה בכל אחד מחלקי הצמח אשר פוגעת בזרימה ובתפקוד תקין של מערכת ההובלה שלו הכוללת את העצה והשיפה. מערכת ההובלה היא כלי חשוב מאוד אשר אחראי על מעבר של מים מהשורש לנוף ומוטמעים מהנוף לשורש, וכן מעבר של חומר גנטי הורמונים ועוד (Lucas et al., 2013). בצמח קיים מנגנון לשחזור רצף צרורות ההובלה, אשר מהווה חלק בלתי נפרד מתהליך איחוי ההרכבה (Melnyk, 2017a; Melnyk et al., 2018). ברוב הצמחים תהליך איחוי ההרכבה דומה עם שינויים בלוחות הזמנים ולעיתים גם שינויים בסדר השלבים השונים.
תחילה, כתגובה לפציעה ניתן יהיה לראות הצטברות של שכבה נקרוטית (תאים מתים) באזור החיתוך (Jeffree and Yeoman, 1983; Hartmann et al., 2011; Cookson et al., 2014). בהמשך יחל תהליך ההצמדות בין הכנה לרוכב שיהיה מושפע מהפרשה של חומרי דבק כמו פקטין, קרבוהידרטים ומספר סוגי חלבונים (Frey et al., 2020). לשלב זה תפקיד בהיווצרות כוחות הדבקה בין הכנה לרוכב אשר חיוניים להצלחת התהליך. בטבק הראו כי כוחות הדבקה ראשונים נוצרים יומיים לאחר ההרכבה (Kawakatsu et al., 2020).
בשלב השני של תהליך האיחוי תחל חלוקה מואצת של תאים אשר תיצור את רקמת הקאלוס, רקמה של תאים בעלי כושר חלוקה ויכולת התמיינות לרקמות שונות באופן תלוי זמן, מקום וסיגנלים ספציפיים (Ikeuchi et al., 2013). רקמת הקאלוס יוצרת את החיבור והקשר הראשוני בין הכנה לרוכב. בצמחים עשבונים רקמת הקאלוס תיווצר זמן קצר לאחר ההרכבה. בצמחי ארבידופסיס (Arabidopsis thaliana), קאלוס יופיע בין שלושה לשישה ימים לאחר ההרכבה (Flaishman et al., 2008) בעוד שבמנגו (Mangifera indica) למשל חלוקת התאים מתחילה לאחר חמישה ימים ושכבת קאלוס משמעותית נוצרת לאחר עשרה ימים (Asante and Barnett, 1997). בצמחים ממשפחת הוורדניים (Rosaceae) ראו התפתחות קאלוס לאחר חמישה ימים (Pina et al., 2012a). כאשר ייווצר חיבור בין תאי הקאלוס של הכנה והרוכב יחל שינוי מקומי בדופן התא, ייווצרו מעברים אליהם תידחס ממברנת התא והרשת האנדופלסמטית ובהמשך יושלמו במקום זה מעברי פלזמודזמטה בין התאים (Pina et al., 2012a). מעברי הפלזמודזמטה הנוצרים הם פלזמודזמטה שניוניים אשר מאפשרים ליצור קשר רציף בין הכנה לרוכב ולכן נראה כי הם חיוניים להמשך תהליך האיחוי (Wang, 2011).
בשלב השלישי, תחל התמיינות לצינורות הובלה (עצה ושיפה) וקמביום מתוך רקמת הקאלוס שנוצר. השלב הרביעי והאחרון יהיה התמיינות של עצה ושיפה משניים (Goldschmidt, 2014).
ככלל התהליך קורה באופן דומה ברוב הצמחים, כאשר את הבדלים בסדר ובקצב השלבים השונים ניתן לייחס לסוג הצמח, גיל הרוכב או הכנה ולסביבה החיצונית (Yin et al., 2012; Melnyk, 2017b).
רקמת הקמביום היא גורם חשוב מאוד בהצלחת תהליך האיחוי. מדובר בשכבה דקה המורכבת ממספר קטן של תאים וממוקמת בין העצה לשיפה (Nieminen et al., 2015; Duman et al., 2020) שכבה זו אחראית על התמיינות צרורות ההובלה והמשך חלקות התאים בצמח (Spicer and Groover, 2010). מחקר שבדק את התגובה לפציעה בגבעול של הפרח ציניה ( Zinnia elegans L.) הראה כי לאחר פציעה נראתה עלייה בפעילות של גנים המתבטאים ברקמת הקמביום ובהמשך התמיינות וחלוקת תאים מואצת באזור החתך (Nishitani et al., 2002). מעבר לכך ,יש הטוענים כי קרבה בין הקמביום של הכנה לקמביום של הרוכב היא הכרחית להצלחת התהליך (Moore, 1984a; Hartmann et al., 2011; Garner, 2013) .על אף טענה זו ניתן לראות כי בצמח וניל למשל, מספיקה קרבה קטנה בין השכבות ואז תאי הפרנכימה המתפתחים יוצרים את הקישור בין רקמות הקמביום של הכנה ורוכב (Muzik, 1958) . כנ"ל לגבי הרכבות באבוקדו (Hadas-Brandwein, 2021) (איור 4 E).
על מנת שהצמח ימשיך להתפתח לאחר השלמת תהליך האיחוי, חייב להיווצר רצף תקין בין הכנה לבין הרוכב המכיל צינורת הובלה מפותחים. בחלק מהמקרים איחוי חלקי עשוי לתפקד אך רק לזמן מוגבל, ולאחר תקופה מסוימת (יכול להיות גם שנים) השתיל יתמוטט (Errea et al., 1994; Errea et al., 2001).
מעקב היסטולוגי אחר תהליך האיחוי
במחקר שנערך במעבדתנו, תועד תהליך איחוי ההרכבה ביצור שתילי אבוקדו. במקרה זה בוצעה הרכבה של רוכבים מצמחי הכנות הוגטטיביות (סדרת VC (Ben-Ya′acov and Zilberstaine, 1999)) על צמחי אם שהונבטו מזרעים. נראה כי הליך איחוי ההרכבה בשתילי אבוקדו מתקיים באופן דומה לשלבים שתוארו בעבר בספרות. תיעוד זה באמצעות חתכים היסטולוגים סיפק תמונות אשר מאפיינות ומציגות את השלבים השונים באופן מדויק ואיכותי יותר אשר מתקף את הידוע עד כה (איור 4).
תהליך איחוי ההרכבה לקח כחודש וחצי והתחיל מפעילות חלוקות תאים שנראתה לראשונה לאחר שישה ימים ברוכב מאזור הליבה. פעילות זאת מתאפיינת בהיווצרות עמודות תאים שטוחים שמתחלקים זה מזה באזור החתך במישור מקביל לחתך (איור 4B חץ). לאחר 10-15 יום ניתן היה לראות חלוקת תאים גם מאזור הכנה בסמוך לקמביום (איור 4C). היווצרות רקמת קאלוס נראתה לאחר 19 יום וכן בזמן זה נראו גם תאים בעלי מאפיינים של טרכיאדים להם דופן משנית מעובה בצורת סליל, המהווים סימנים ראשונים להתמיינות רקמות הובלה של העצה (איור 5). לאחר 20-35 יום נראה חיבור של רקמת הקמביום (איור 4 E ) בו נוצרת מעין קשת ה"מתקנת" את אי ההתאמה במיקום הרקמה בין הכנה לרוכב. לאחר 40-50 יום, נראה איחוי מלא בין הכנה לרוכב כולל התמיינות מחודשת של רקמות העצה והשיפה (איור 4 F ).
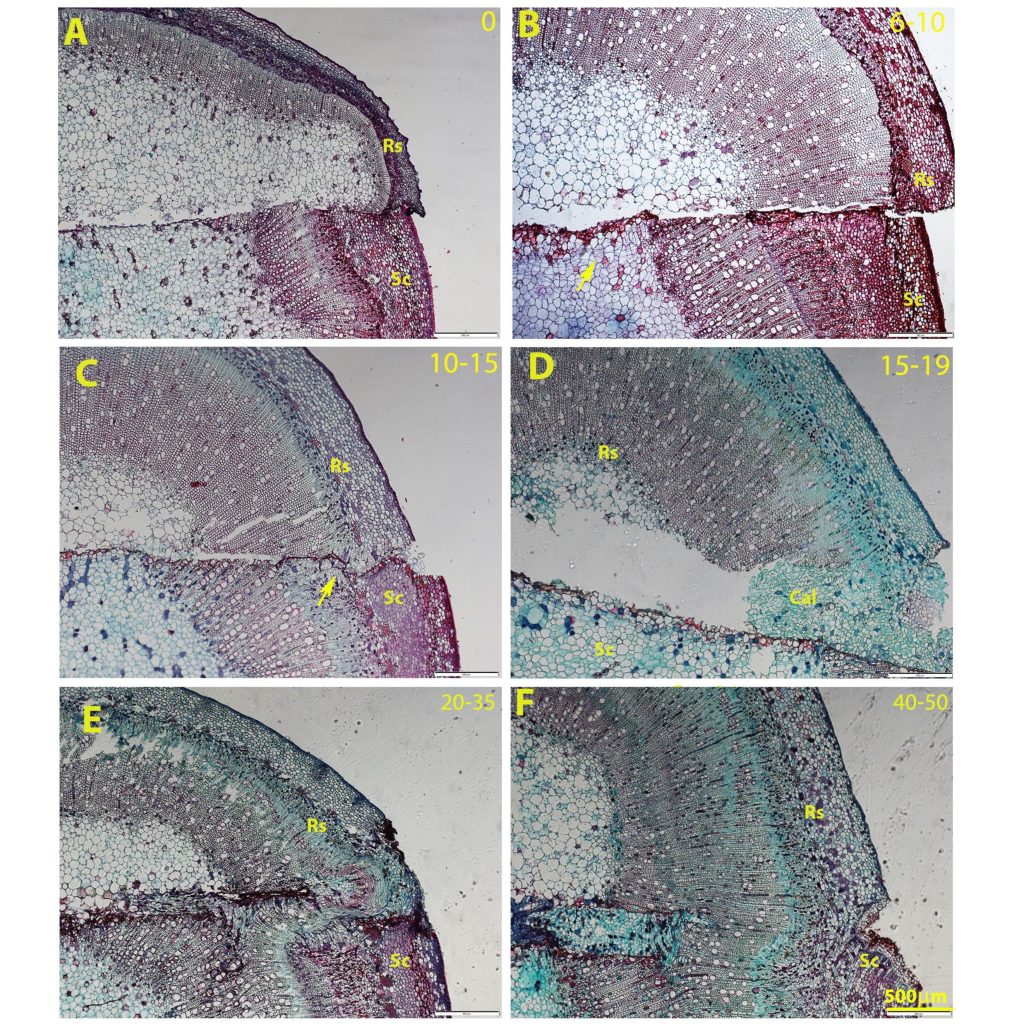
איור 4- תהליך איחוי ההרכבה בשתילי אבוקדו צעירים.
A ) יום ההרכבה, לא נראית חלוקה של תאים; B) שישה ימים לאחר ההרכבה, תחילת חלוקת תאים מהרוכב לכיוון הכנה מהליבה (חץ); C ) חלוקת תאים גם מהכנה וגם מהרוכב (חץ) D 😉 היווצרות קאלוס; (E תחילת התמיינות של צינורות הובלה ויצירת רצף בין הכנה והרוכב הכולל קשת לתיקון ההסטה בין קמביום הכנה לרוכב; F) איחוי מלא של אזור ההרכבה והתמיינות של צינורת הובלה משניים. שמות קוד לתמונות : רוכב (Sc), כנה (Rs), קאלוס (Cal).
מהחתכים שבצענו במספר שלבים בתהליך האיחוי נראה כי כיוון חלוקות התאים הוא כלפיי החתך. בהקשר זה מעניין לציין שבעבר הוכח כי כיוון חלוקות תאים מושפע בין היתר מגירוי מכני (Lintilhac and Vesecky, 1984; Louveaux et al., 2016), ולכן הידוק הכנה לרוכב מהווה כנראה מרכיב חשוב המתווה את כיוון חלוקות התאים בהם זה לכיוונו של זה. בנוסף נמצא שחלוקות התאים בתהליך האיחוי יכולים להתחיל לפחות משלושה סוגי תאים, מהליבה, באזור פרנכימת השיפה, ובנוסף מהקמביום (איור A 5). ממצא זה מתאים למחקרים שנעשו במאה הקודמת שהראו כי חלוקות תאים בזמן איחוי הרכבה מתקיימות ברקמות הליבה, הקמביום, ופרנכימה של העצה, בתפוח (Malus domestica) ובמחטניים (Pinopsida) (Sass, 1932; Barnett and Weatherhead, 1988).
בנוסף מצאנו בהרכבות האבוקדו שישנה קורלציה בין הצלחת האיחוי הרקמתי בין הכנה לרוכב לבין לבלוב הפקע הצדדי ברוכב שמסמן מבחינה חקלאית את הצלחת ההרכבה. ראינו כי כאשר הניצן פורץ ברוב המקרים כבר יש רצף רקמות מסוים בין הכנה לרוכב. באיור מספר 6 ניתן לראות שני שתילים 20 יום לאחר ההרכבה, בצמח אחד פרץ ניצן (איור 6 ,A C ) ובשני לא (איור 6 ,B D ). בצמח בו ההרכבה לא פרצה, לא נראתה התקדמות באיחוי ברמת הרקמה (איור 6A) , ואילו בחתך שנלקח לאחר 20 יום מהצמח בו כן פרץ פקע נראה רצף תאים ברור בין הכנה לרוכב (איור 6B)
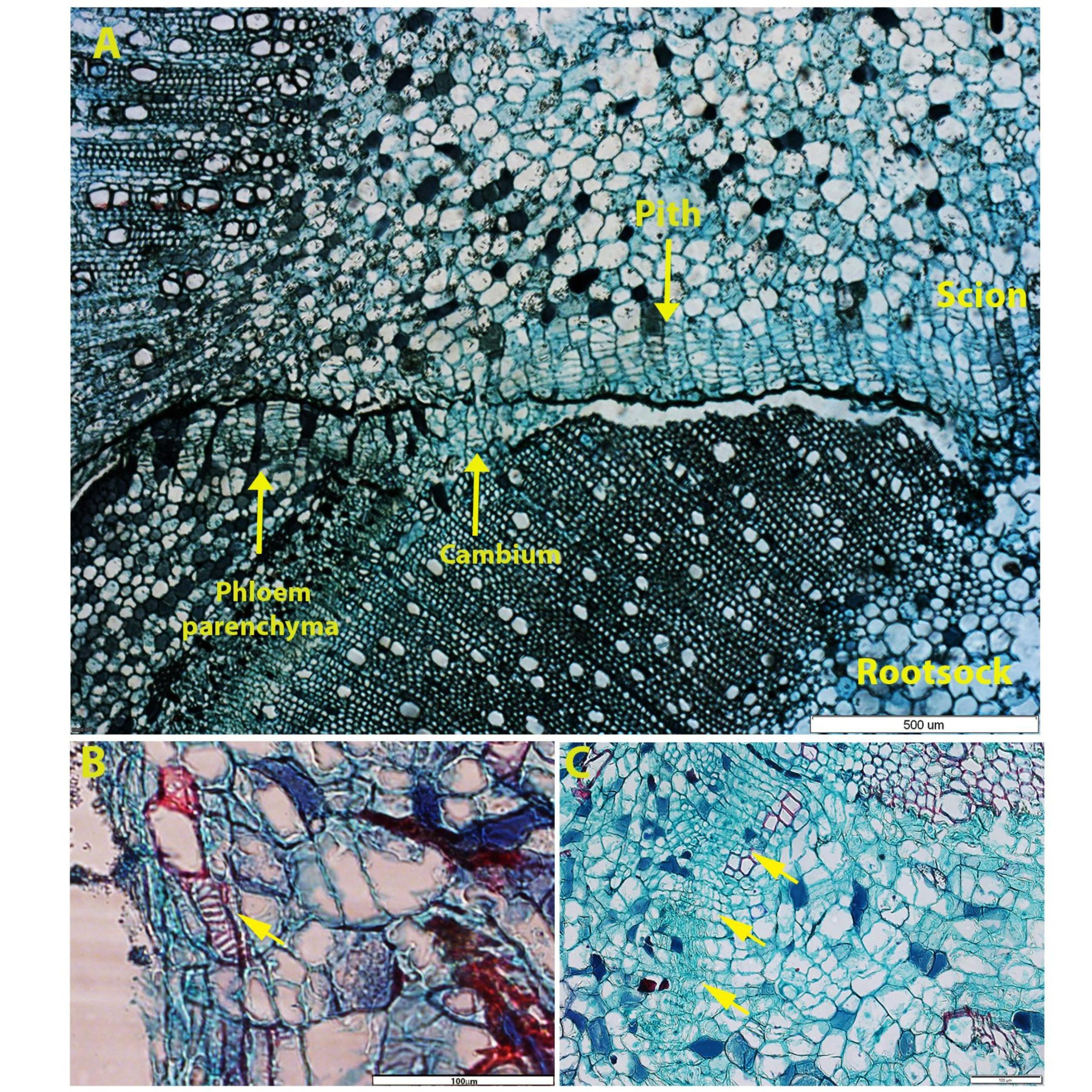
איור 5– תקריב של שלבים שונים בתהליך ההתמיינות
. (A התמיינות משלושה אזורים- קמביום, פרנכימיה של השיפה וליבה; B) התמיינות צינורת עצה מהקאלוס בין הכנה לרוכב לאחר 19 יום; C) אינדיקציה להתמיינות קמביום בין הכנה לרוכב לאחר 19 יום .

איור 6– קורלציה בין לבלוב הרוכב לאיחוי ההרכבה
. A)+C) חתך מהרכבה שלא פרצה ,20 יום לאחר ההרכבה; B)+(D חתך מהרכבה שפרצה ,20 יום לאחר ההרכבה.
גורמים המשפיעים על הצלחת תהליך האיחוי
כפי שפורט לעיל, תהליך איחוי ההרכבה הינו תהליך מורכב אשר הצלחתו מושפעת מגורמים רבים. כשל בהצלחת הרכבה עשוי לנבוע מאי התאם, כלשהו בין הכנה לרוכב. במצב זה תהיה הפרעה מסוימת ביצירת רצף קמביום וצרורות הובלה בין הכנה לרוכב (Goldschmidt, 2014). זהו מונח רחב מאוד המושפע מגורמים פסיולוגים, סביבתיים וכן גנטיים המתרחשים במקביל ולכן קשה לקבוע אילו גורמים נכנסים תחת הגדרה זו. לרוב, במצב של אי התאם ניתן יהיה לראות מספר סימפטומים חיצוניים ביניהם אחוזי הצלחה נמוכים, קשיים בצימוח וגטטיבי, מוות של הכנה, קצב גדילה שונה (של הכנה או הרוכב) והיווצרות עיוות באזור האיחוי ( בקבוק הפוך) (Hartmann et al., 1990). אי התאם עשוי להתבטא גם בפגיעה בהתמיינות צרורות ההובלה והצטברות של תרכובות פנוליות שונות (Cookson et al., 2014). אי התאם עשוי להופיע בשלב מאוחר יותר לאחר שנראה כי ההרכבה כבר התבססה. במקרה זה נראה מעבר לקוי של חומרי צמיחה שונים בין הכנה לרוכב שיגרמו לצמיחה מעוותת או למוות של הכנה או הרוכב. סוג זה של אי התאם יכול לנבוע מאיחוי לא תקין וחוסר היווצרות של צרורות הובלה או לחלופין הבדל בקוטר הכנה והרוכב שגורמים לזרימה לא תקינה בצרורות ההובלה (Souza et al., 2018). מספר מחקרים אשר בחנו את תופעת האי התאם בצמחים מעוצים הראו כי קיים כשל מסוים בארגון וחלוקת התאים באזור האיחוי. במשמש (Prunus armeniaca), מצאו כי במצב של אי התאם ניתן לראות חוסר ארגון של רקמת הקמביום (Errea et al., 2001; Pina et al., 2012a) והציעו כי מופע זה יכול להיות סימן ראשוני לאי התאם. בצמחים ורדניים (Rosaceae) הראו כי במצב של אי התאם חל עיכוב בהתפתחות מעברי הפלזמודזמטה (Pina et al., 2012a). על פי הידוע מהעבר, התפתחות קאלוס אינה נפגעת ממנגנון האי התאם. קאלוס יתפתח בכל מקרה כתגובה לפציעה ולא דורש זיהו בין תאי(Moore, 1984b; Ikeuchi et al., 2019).
יש הנוהגים לחלק את אי ההתאם לשני סוגים: מועבר " translocated" ומקומי "localized". במקרה הראשון המופע יתבטא לרוב בהתפתחות לא תקינה של הצמח, נראה עיוות עלים, הצהבה ונשירה שלהם וכן מעבר לא תקין של חומרים בין הכנה לרוכב .(Reig et al., 2018) באי התאם מהסוג "localized" נובע לרוב מגורמים כמו חוסר רצף בין הקמביום של הכנה והרוכב, קצב איטי של התמיינות וחלוקת תאים וחוסר סדר וארגון של התאים המובילים בסופו של דבר לניתוק הכנה מהרוכב ותמותה (Dogra et al., 2018). דוגמא לאי התאם מסוג זה נראית בין אגס (Pyrus) לחבוש (Cydonia oblonga), כאשר החבוש מפריש אנזים שנקרא prunasin , אנזים זה אינו פעיל באגס, הוא משתתף בשרשרת המטבוליטית ליצור חומצה פרוסית (ציאניד) המשבשת את חלוקת תאי הקמביום באזור האיחוי וכן את היווצרות רקמת השיפה (Hudina et al., 2014) .
אחד הגורמים הקריטים ביותר להתאם בין כנה לרוכב הוא הקרבה הגנטית ביניהם. לרוב הרכבה מוצלחת תהיה בצמחים בני אותו מין, לעיתים יותר נדירות בין צמחים מאותו סוג ולעיתים רחוקות בין צמחים בני אותה משפחה. בדרך כלל אי אפשר בכלל להרכיב זה על זה צמחים שאינם בני אותה משפחה. כך שככל שהקרבה הגנטית גדולה יותר להרכבה יש יותר סיכוי להצליח (Dogra et al., 2018; Rasool et al., 2020). במשפחת הדלועים נהוג להשתמש היום במינים וסוגים קרובים בתור כנות על מנת להתגבר על בעיות שונות בקרקע כמו למשל הרכבה של אבטיח (Citrullus lanatus) על כנות של דלעת (Cucurbita) (Huang et al., 2016). דוגמא מצמחים מעוצים היא הרכבה בתוך הסוג של עץ אלת הפיסטוק (Pistacia vera) על כנות של אלה ממינים אחרים (Pistacia ) (del Carmen Gijón et al., 2010). שימוש נוסף ביכולת הרכבה בצמחים בני אותו סוג או מין ומבוצע בעיקר בשוק הפרטי והשתלני, הוא יצור "רב בוסתן" . במצב זה מרכיבים על עץ אחד מספר מינים שונים אשר מאפשרים להנות ממספר פירות על עץ אחד, למשל בהדרים ניתן ליצור עץ המכיל ענפים של תפוז דם ותפוז רגיל על אותו עץ, כך גם בסוגי פירות נוספים. במקרה זה חשוב לשים דגש על בחירת הזנים אותם רוצים להרכיב יחד. לדוגמא, לא מומלץ לשלב זן עם צימוח נמרץ יחד עם זן בעל צימוח מרוסן. שילוב כזה עשוי לגרום למצב בו הזן הנמרץ ישתלט על הגידול וידכא את הזן המרוסן (משתלת חסקלברג- ידע אישי). על אף החשיבות הגדולה של הקרבה הגנטית, ניתן לראות מקרים של הצלחה גם כאשר מדובר בהרכבות של צמחים בני סוג שונה אך מאותה משפחה. במשפחת הסולניים למשל בהרכבה של עגבניה (Solanum lycopersicum) על פלפל (Capsicum annuum) מתקיים אי התאם מלא בעוד בהרכבה של עגבניה על חציל (Solanum melongena) מתקיים רק אי התאם חלקי (Kawaguchi et al., 2008), וניתן להרכיב עגבניה בהצלחה רבה על תפ"א (Solanum tuberosum) (Arefin et al., 2019). לאחרונה הצליחו להרכיב רוכב של טבק (Nicotiana benthamiana) המשתייכת למשפחת הסולניים על כנת ארבידופסיס (Arabidopsis thaliana) המשתייך למשפחת המצליבים. ההרכבה אומנם הצליחה אך הצימוח לאחר מכן היה איטי והצמח לא שרד לאורך זמן (Notaguchi et al., 2015; Notaguchi et al., 2020) .לעומת זאת, בליצי (Litchi chinensis) הראו כי הצירוף בין זנים שונים של אותו מין עשוי לגרום לאי התאם בהרכבה, למשל בין הזן ‘Jingganghongnuo’ לזן zhuangyuanhong (Chen et al., 2017). באבוקדו (Persea americana), בחנו אחוזי הצלחת ההרכבה של הזן האס על זנים שונים של כנות מושרשות. נמצא שאחוז ההצלחה בהרכבה על כנה VC801 המושרשת היה הנמוך ביותר לעומת כנותVC51 ו VC256 . לעומת זאת התקבלו אחוזי איחוי גבוהים על כנות אלו כאשר היו בעצמן מורכבות על זריע ולאחר טיפול באטיולציה (Hadas-Brandwein, 2021). ממצא זה מרמז על אפשרות לאי התאם פיזיולוגי, ועל שונות בין זני כנות האבוקדו בכושר הרגנרציה שלהן בזמן הרכבה. השונות בין זנים שונים ביחס לכושר הרגנרציה שלהם תועדה בספרות. מחקר שנעשה בקנה סוכר (Saccharum) מצא כי למינים שונים של הצמח יכולת שונה בפיתוח קאלוס ורגנרציה (Gandonou et al., 2005). גם במחקר שנעשה בזיתים (Olea europaea) ראו שהיכולת ליצר עוברים סומטים מרקמות שונות של הצמח תלויות בין היתר בזן הנבחר (Mazri et al., 2010).
גיל הכנה או הרוכב יכולים גם הם להשפיע על סיכויי ההצלחה. במחקר שנעשה בפלפל (Capsicum annuum) הראו כי הצלחת הרכבה על כנה בת 58 יום היה נמוך לעומת הרכבה על כנה בת 34 ימים. בכנה הבוגרת ראו קשיים בהתמיינות של הקאלוס והתמיינות איטית יותר של עצה (Lee, 1994; Johkan et al., 2009). בנוסף, בפפאיה (Carica papaya) הראו כי אחוז ההצלחה עולה ככל שהכנה צעירה יותר (Nguyen and Yen, 2018). באבוקדו (Persea americana), השימוש בשיטת פרויליך הכולל הרכבת כנות על זרע אומנת ואטיולציה (איור 7) מסייע להצלחת ההרכבה של הזן בהמשך בשיעורים גבוהים בניגוד להרכבת הזן על אותה כנה כאשר היא ירוקה וגדלה על שורשיה (Hadas-Brandwein, 2021), נתון זה תומך בהשערה כי הצלחת ההרכבה במקרה זה נתמכת מגורמים לא ידועים אשר מגיעים מהזרע ומהענף האטיולנטי (Hadas-Brandwein, 2021).
תנאי הסביבה גם הם בעלי חשיבות גדולה מאוד להצלחת תהליך האיחוי. הטמפרטורה והעונה בשנה ישפיעו מאוד על אחוז ההצלחה של הרכבה והשפעתן שונה בין סוגי הצמחים. טמפרטורה למשל יכולה לפגוע בהתמיינות של רקמת הקאלוס בתפוח (Malus domestica). בעוד שבטמפרטורה של בין 32 ל40 מעלות ההתמיינות היא מיטבית, טמפרטורה נמוכה יותר תאט ואף תפסיק את התהליך ואילו טמפרטורה גבוהה יותר תגרום למוות של הרקמה (Yin et al., 2012; Melnyk, 2017b). מלבד הטמפרטורה גם העונה בשנה היא בעלת חשיבות. ברוב הצמחים נוהגים לבצע את ההרכבה בזמן שהצמח נמצא בתקופת הצימוח הפעיל שלו, בישראל ברוב המקרים מדובר בתקופת האביב, אך כל צמח דורש תנאים שונים. בתפוזים (Citrus sinensisp) למשל נהוג להרכיב בעונת האביב או הסתיו (Salik et al., 2015), בפאפיה (Carica papaya) מצאו שדווקא הקיץ הוא המועד המתאים ביותר להרכבה (Nguyen and Yen, 2018),ואילו בקרמבולה (Averrhoa carambola) הראו כי אחוזי ההצלחה הגבוהים ביותר היו ביולי (Ghosh and Bera, 2015). על פי הידוע לנו משתלנים וחקלאים בארץ, במטעי אבוקדו בוגרים נהוג לבצע הרכבה להחלפת זן על הגזע של העץ הקודם, בעונת האביב כאשר התנאים הם מיטביים. לעומת זאת, כאשר מדובר ביצור שתילים לרוב נוהגות המשתלות להרכיב בין החודשים אוקטובר לפברואר, כיוון שזהו מועד מתאים הן מבחינת מועד נביטת הכנות והן מבחינת מצב הרוכבים. עוד ידוע משתלנים בארץ כי הרכבה בזמן הפריחה אינה מומלצת לרוב (תקשורת בעל פה). גורם נוסף אשר משפיע על הצלחת התהליך הוא מיקרו האקלים באזור ההרכבה, יש לשמור על לחות מספקת בכדי למנוע התייבשות של הכנה או הרוכב ומצד שני למנוע רטיבות יתר אשר עשויה לגרום לרקבונות (Baron et al., 2019). בנוסף לאלו, גורמים ביוטים שונים כמו זיהומים בצמח גם הם ישפיעו על תהליך איחוי ההרכבה (Hartmann et al., 2011).
מחקרים להבנת המסלולים המולקולריים המשתתפים באיחוי הרכבה
על אף הידע הנרחב שקיים בתחום ההרכבות והשימוש בשיטה לאורך שנים, הבנת המנגנון המולקולרי העומד בבסיס תהליך האיחוי לקתה בחסר במשך זמן רב, ביחוד בצמחים מעוצים. בשנים האחרונות מספר מחקרים החלו לאפיין את המנגנון בעיקר באמצעות צמחי מודל עשבוניים ובמספר קטן של צמחים מעוצים. במחקרים אשר בחנו את פרופיל ביטוי הגנים בזמן הרכבה של צמחים מעוצים ביניהם בגפן (Vitis vinifera) וליצי (Litchi chinensis) הראו כי מספר ימים לאחר ההרכבה נראתה עליה בעיקר בביטוי גנים אשר קשורים לדופן התא, תגובה להורמונים וכן גנים הקשורים למטבוליטים שניונים בתאים (Cookson et al., 2013; Qiu et al., 2016; Chen et al., 2017). חלוקה מחודשת והתמיינות של צרורות ההובלה תלויה בין היתר במודיפקציות המתרחשות בדופן , חלק מהגנים שביטויים עלה במספר מחקרים בנושא הם גנים ממשפחת expansin וxyloglucan endotransglucosylases אשר פועלים לריכוך הדופן וזוהו כפרוקורסורים חשובים בהתמיינות (Nishikubo et al., 2011; Pina et al., 2012b). בנוסף, ביטוי שלהם מגביר את גדילת התאים ודיכוי שלהם עוצר אותם (Zenoni et al., 2004; Buckeridge, 2010).
נראה כי רוב הגנים אשר מתבטאים בשלבים הראשונים של ההרכבה יהיו בתגובה לפציעה שכשלעצמה עשויה לעודד חלוקת תאים ותחילת התמיינות של קאלוס. בארבידופסיס, הגן WIND1 (wound induced dedifferentiation 1 ) הראה ביטוי גבוה מאוד לאחר הפציעה ולאחריו נראתה התמיינות של רקמת הקאלוס (Iwase et al., 2011). בנוסף, בשלב הפציעה ניתן לראות בין היתר גם גנים הקשורים לתגובה לפתוגנים וכן גנים הקשורים לתגובה לעקה. במידה ותהליך האיחוי יתנהל כשורה תראה ירידה בביטוי של גנים אלו לאחר זמן קצר (משתנה כתלות בסוג הצמח) ותתחיל עליה בביטוי של גנים הקשורים יותר לתהליך האיחוי כמו גנים ספציפיים לתאי עצה ושיפה. בארבידופסיס שינויים אילו יראו לאחר 72 שעות (Melnyk, 2017a; Melnyk et al., 2018). במידה ויהיה כשל כלשהו בהרכבה , כמו במצב של אי התאם ביטוי הגנים הקשורים למצבי עקה עשוי להישאר גבוה. מחקר שנערך בגפן (Vitis vinifera) השווה בין הרכבה בין מינית לבן הרכבה עצמית ומצא כי בזמן הרכבה בין מינית ישנה עליה משמעותית בביטוי של גנים אשר קשורים לתגובה לעקה או למנגנוני הגנה של צמח מפני פתוגנים (Cookson et al., 2013; Cookson et al., 2014).
ב2018 פורסם מחקר אשר בחן את פרופיל ביטוי הגנים בזמן ההרכבה בארבידופסיס בשלבים שונים של תהליך האיחוי. על מנת להבדיל בין גנים של פציעה לאלו של הרכבה, בוצע מעקב אחר ביטוי הגנים בצמחי ארבידופסיס מורכבים לעומת צמחים שנחתכו אבל שלא עברו הרכבה. ביטוי הגנים נבדק בנפרד בכנה וברוכב בפרקי זמן קבועים (Melnyk et al., 2018). החוקרים הראו כי בתהליך ההרכבה שלא כמו בתהליך הפציעה ללא הרכבה, נראה עליה ביטוי של גנים אשר קשורים להתמיינות צרורות ההובלה, כאשר גנים שקשורים להתמיינות של קמביום ושיפה יופיעו בשלבים הראשונים וגנים הקשורים להתמיינות עצה יופיעו בשני גלים, חלק בשלב הראשון עד כ72 שעות לאחר ההרכבה ,זאת על אף שלא נראה חלוקת תאי עצה בפועל, וחלק יקרה בפועל בשלבים מאוחרים יותר (כ120 שעות לאחר ההרכבה) כאשר תאי העצה מתמיינים. בנוסף נראה כי אין בהכרח סימטריה בביטוי הגנים בין הכנה לרוכב, עליה בביטוי גנים הקשורים להתמיינות תאים, שיפה וקמביום נראתה תחילה ברוכב ומאוחר יותר בכנה. עוד ראו כי גנים אשר קשורים לחלוקת תאים נראו 12 שעות לאחר ההרכבה ברוכב ורק לאחר 24 שעות בכנה. על אף אי הסימטריה בין הכנה לרוכב, נראה כי כן ניתן לראות ביטוי שווה של גנים הקשורים לתגובה לאוקסין. גנים אשר מעידים על פעילות של אוקסין מצטברים הן בכנה והן ברוכב כ 12 שעות לאחר ההרכבה.
הורמונים המעורבים בתהליך האיחוי ושימוש באוקסין בהרכבות
כאמור, תחילת תהליך האיחוי דורשת תהליך חלוקה מחודשת של תאים ורגנרציה. הורמונים צמחיים הם רגולטורים חשובים בכל התהליכים המתרחשים בצמח החל מהתפתחות העובר ועד להתפתחות הפירות (Rasool et al., 2020), באופן דומה להורמונים צמחים גם תפקיד חשוב מאוד בבקרה על תהליך איחוי ההרכבה.
אחד ההורמונים המרכזיים בתהליך הוא ההורמון אוקסין אשר מבקר בין היתר התמיינות חלוקה והתארכות של התאים בצמח (Teale et al., 2006). לאחר הפציעה נראית הצטברות של אוקסין באזור החתך. Yin הראה באמצעות ניתוח היסטולוגי של תהליך איחוי ההרכבה בארבידופסיס וכן אפיון הורמונלי וגנטי שלו כי הצטברות של אוקסין מעודדת חלוקה של תאים אשר יוצרת את החיבור בין הכנה לרוכב (Yin et al., 2012) . מעבר לכך, ההשערה היא שכחלק ממנגנון התגובה לפציעה ניתן לראות הצטברות ושינוי מיקומם של חלבונים הקשורים לתנועת אוקסין בצמח, בינהם הטרנספורטר PIN1, הגורמים להובלה קוטבית מוכוונת של אוקסין התומכת ביצירת תקשורת בין תאית ומעודדת יצירת גרדיינט של אוקסין שחשוב לחלוקה והתמיינות מחודשת באזור הפצע (Sauer et al., 2006; Mazur et al., 2016). בצמחי אפונה בהם נחתך הגבעול נראתה עליה בביטוי של PIN1 באזור הפציעה, לאחר מכן התמיינות של צינורות עצה (Sauer 2006). בהרכבה בארבידופסיס נראתה עליה בביטוי של Auxin-responsive promoter DR5 , סמן לפעילות אוקסין, כשלושה ימים לאחר ההרכבה. מלבד חלוקת תאים, ידוע כי ההורמון אוקסין קריטי להיווצרות צרורות ההובלה. בחתכים של צמחי ארבידופסיס בהם עוכבה הובלת האוקסין נראתה פגיעה בהתמיינות של צרורות ההובלה, אולם, לאחר ישום אוקסין חיצוני נראתה התחדשות של חלוקת התאים (Asahina et al., 2011). הוכחה נוספת לחשיבות ההורמון אוקסין בתהליך ההרכבה הראה Melnyk אשר עקב אחר התהליך בצמחי ארבידופסיס, הוא הראה כי כאשר הרכיבו רוכבים מזן הבר על כנות מוטנטיות לגנים הקשורים בקליטת אותות של אוקסין (alf4, או axr1 או ,iaa18) או על המוטנט המשולש ברצפטור לאוקסין ( tir1/afb2/ afb3) היה עכוב בהתמיינות רקמת השיפה באזור ההרכבה. מעניין לציין כי כאשר השתמשו באותו מוטנט בתור הרוכב לא ראו בעיה בהתמיינות שיפה מה שמעיד על אי סימטריה מסוימת בין הכנה לרוכב (Melnyk et al., 2015). במחקר מאוחר יותר הראו כי עד לחידוש תאי השיפה ויצירת קשר רציף בין הכנה לרוכב ישנה עליה בריכוז העמילן ברוכב, מצב זה מתאזן לאחר חיבור ראשוני בין הכנה לרוכב (Melnyk et al., 2018). מחקר נוסף בארבידופסיס בדק את השפעת הטיפול במעכב הובלת אוקסין TIBA או בהסרת הפסיגים בזמן ההרכבה. החוקרים הראו כי שתי פעולות אילו דכאו את ביטוי של הגנים IAA5, ANAC071, ANAC096 ו-CYCB1;1. אשר מעורבים בחלוקות תאים ובתהליך האיחוי, ואכן שני הטיפולים דכאו את המשך התמיינות התאים (Matsuoka et al., 2016). רמות ביטוי האוקסין בתא משפיעות גם על סדר וגם על אופי הרקמה שתתפתח. במחקר שעשה אלוני ב1995 הראה כי ריכוז נמוך של IAA מעודד התפתחות שיפה ואילו ריכוז גבוה מעודד התפתחות של עצה (Aloni, 1995).
אוקסין משמש כהורמון המרכזי בתהליך האיחוי אך הוא אינו פועל לבד, יחד עם הורמונים נוספים הוא מבקר את השלבים השונים בתהליך. ההורמון ציטוקינין הוכח כחשוב בתהליך איחוי ההרכבה כיוון שהוא מעורב בהתמיינות רקמת הקאלוס. בגפן, הראו כי שימוש בסוגים שונים של ציטוקינין סינטטי, בינהם benzyladenine (BA) ו-kinetin (Ki) גרמו לעליה בהתמיינות של רקמת הקאלוס בזמן ההרכבה (Köse and Güleryüz, 2006). בנוסף, שימוש בצמחי ארבידופסיס מוטנטים לגנים ממשפחת ARR (Arabidopsis response regulators), פקטורי שעתוק אשר מעורבים במנגנון חישת הציטוקינין, גרמו לירידה ברגישות לציטוקינין וכתוצאה מכך להתמיינות לקויה של שורשים והתפתחות קאלוס (Mason et al., 2005). מעבר לכך, מספר מחקרים הראו כי עליה בריכוז של ציטוקינין מגבירה את רגישות התאים לאוקסין ואת חישתו ובכך גורמת לחלוקה והתמיינות של צרורות הובלה (Aloni, 1993; Shehata and El-Shraiy, 2010). בנוסף לכל אלו מחקרים רבים הראו מעורבות של ההורמון ציטוקינין בתהליכי התמיינות שונים המתרחשים במהלך ההרכבה כמו בקמביום ויצירת רקמת עצה ראשונית (Nanda and Melnyk, 2018; Sharma and Zheng, 2019). יחד עם ציטוקינין ואוקסין גם לג'יברלין מעורבות בתהליך ההתמיינות. Dayan הראה כי ירידה בריכוז של ג'יברלין בצמחי טבק הפחיתה משמעותית את פעילות רקמת הקמביום וכן נראתה ירידה בהתמיינות של צרורות עצה (Dayan et al., 2012). בנוסף שימוש במוטנט gal-3, גן אשר אחראי לביוסנתזה של ג'יברלין, הראה פגיעה בהתמיינות צינורת עצה (Ragni et al., 2011). כמו ציטוקנין גם ג'יברלין פועל בשיתוף עם אוקסין על מנת לבקר חלוקת תאים והתמיינות של צרורות הובלה משניים. הג'יברלין פועל באזור הקמביום ומעודד הובלה קוטבית של אוקסין (polar auxin transport (PAT) על ידי ביטוי ביתר של PIN1 (Chawla and DeMason, 2004; Björklund et al., 2007)
בנוסף להורמונים שצוינו עד כה, בזמן תהליך איחוי ההרכבה נראתה עליה בביטוי של הורמונים נוספים כמו אתילן וחמצה ג'סמונית (Aloni et al., 2010; Qiu et al., 2016; Sharma and Zheng, 2019). הורמונים אלו הראו עליה בביטוי בתגובה לפציעה ונראה כי מעורבים במנגנון תגובה למצבי עקה שונים בצמח. בנוסף הראו כי פעילות משותפת של ההורמונים הללו ואוקסין חשובה בבקרה על תהליך התמיינות צרורות ההובלה (Nanda and Melnyk, 2018). במהלך השנים עלו במחקר גם השערות לכך שחומצה אבססית משפיעה גם היא על תהליך ההתמיינות בשל היותה הורמון הפועל במצבי עקה (Nanda and Melnyk, 2018). נמצא קשר מסוים בבקרה של הורמון זה על התפתחות צרורות ההובלה (Oh et al., 2003). בנוסף, נראתה עליה של ABA במקביל לפציעה אך לא ברור האם העלייה הייתה בתגובה לפציעה עצמה או לחלופין בתגובה להתייבשות ומוות התאים כתוצאה מכך (Birkenmeier and Ryan, 1998). נראה כי שלושת ההורמונים (אתילן, ח' ג'סמונית וח' אבסיסית) מעורבים במידה מסוימת בתהליך האיחוי אך נכון לזמן זה לא נמצא קשר מובהק ביניהם לבין כשל בתהליך האיחוי. המחקרים בנושא זה ישנים ולא רבים, ולכן, על מנת ללמוד טוב יותר את מעורבותם בתהליך יש לבצע מחקר נוסף.
לסיכום הרשום לעיל, נראה כי אוקסין הוא ההורמון בעל ההשפעה הגדולה ביותר. בשונה מהשימוש המקובל באוקסין לשם השרשת ייחורים, לא מוכר שימוש מסחרי באוקסין בהרכבות. מספר מחקרים שבוצעו בעבר הראו רמזים לכך ששימוש חיצוני באוקסין אכן יכול לסייע לשיפור תהליך האיחוי (Shimomura and Fuzihara, 1977; Kumar et al., 2018), אך מדובר במחקריים ראשוניים בלבד. במחקר שבוצע במעבדתינו ראינו רמזים ראשונים לכך ששימוש באוקסין בזמן ההרכבה יכול לסייע ולזרז את תהליך האיחוי. שיטה זו התגלתה כיעילה במיוחד כאשר הרוכב או הכנה לא במצב אופטימאלי מבחינה פיזיולוגית. טיפולים שעשינו באוקסין עזרו בהעלאת אחוזי הצלחת ההרכבה של האס וג'אם הכנות VC320, VC159, VC801 שאמנם הורכבו על נבטים של זרעי אומנות אבל עברה שנה שלמה מאז והצמח התבגר והתעצה. בניגוד לכך, טיפולי אוקסין לא עזרו לשיפור איחוי ההרכבה על שתילים שמקורם בייחורי אבוקדו מושרשים ויתכן שאף עיכבו אותו בכנות מסוימות (Hadas-Brandwein, 2021). הגורם לכך לא ברור, וכנראה שנדרש כיול נוסף של הטיפול. מחקר שנעשה בעצי צפצפה מצא כי שינויים ברמות האוקסין בצמח לאורך עונות השנה משפיעים על יכולת ההשתרשות של העץ. במהלך המחקר בוצעו יישומים חיצוניים של אוקסין בתקופות שונות של השנה ובדקו את השפעתם על יכולת ההשתרשות. מתוצאות המחקר נראה כי השינויים העונתיים ביעילות מתן של אוקסינים אקסוגנים קשורים גם לרמת האוקסין האנדוגני. ביוני כאשר האוקסין האנדוגני היה גבוה עקב פעילות מריסטמטית גבוהה, נראה כי טיפול חיצוני של אוקסין גרם לעליה גבוהה מידי בריכוז אשר פגעה בהשתרשות אל מול צמחי הביקורת. לעומת זאת, במהלך חודש אוקטובר, טיפול באוקסין אקסוגני, הגביר את ההשתרשות על ידי העלאתו לרמה אופטימלית, שכן ייצור האוקסין האנדוגני בעונה זו ירד בהדרגה עקב הירידה בטמפרטורות (Nanda and Anand, 1970). יתכן שניתן להסיק שגם בהרכבות תוספת אוקסין מתאימה רק במקרים של חוסר טבעי. על מנת להסיק מסקנות וללמוד טוב יותר על תרומתו של יישום אוקסין חיצוני בתהליך ההרכבה יש צורך במחקר נוסף.
דוגמאות לשימוש בהרכבות בחקלאות ובמחקר
כאמור, הרכבות הן כלי מרכזי לריבוי צמחים. מעבר ליתרונות המוכרים שצוינו בכתוב מעלה, כלי זה משמש להתגבר על מגבלות ריבוי של זנים אשר אינם משתרשים בקלות. באבוקדו למשל, אינדוקציה של שורשים אדוונטיבים מייחורים בוגרים היא קשה מאוד וריבוי בעזרת תרביות רקמה כיום לא אפשרי בכמויות מסחריות. בעקבות הצורך בריבוי כנות באופן וגטטיבי על מנת לשמר תכונות רצויות כמו עמידות למחלות קרקע, אחידות ופוריות, פותחה לפני חמישים שנה שיטה מיוחדת לריבוי כנות וגגטיביות באבוקדו (Persea americana), על ידי Frolich (Frolich and Platt, 1972) . שיטה זו מתבססת על שתי הרכבות ומשמשת עד היום ככלי המסחרי היחידי לריבוי כנות וגטטיביות של אבוקדו (Brokaw, 1975; Ernst and Holtzhausen, 1978; Goren, 1982). איור מס' 7 מתאר את שלבי היצור השונים של השיטה. בשיטה זו מרכיבים ענף בעל פקעים של הכנה הוגטטיבית הרצויה על זרע אומנת. לאחר התעוררות וצימוח הפקעים של הכנה (עכשיו משמשת בתור רוכב) מגדלים את השתיל בחושך על מנת ליצר צימוח אטיולנטי. לאחר צימוח מספיק של הענף האטיולנטי, פוצעים אותו ומטפלים באוקסין כדי לסייע בהשתרשות, מכסים את חלקו התחתון של הענף, שטופל באוקסין, באדמה, ולאחר מכן מרכיבים את הזן המבוקש על חלקו העליון. לאחר התבססות השתיל והשתרשות הכנה מנתקים את זרע האומנת והשתיל מתבסס על שורשי הכנה בלבד.

איור מס' 7- תיאור שלבי היצור של כנה וגטטבית
A) הנבטת זרע אשר ישמש כזרע אומנת. B) הרכבת זן הכנה הרצויה על זרע האומנת. C) פריצת ההרכבה. D) גידול בחושך ליצור צימוח אטיולנטי. (E ישום אוקסין והגבהת מצע. F) הרכבת הזן והשרשת הכנה הוגטטיבית מגבעול אטיולנטי מורכב על זרע אומנת . G) התפתחות הרוכב וניתוק זרע האומנת. H). שתיל אבוקדו מורכב מוכן לשיווק. אילוסטרציה מתוך (Hadas-Brandwein, 2021)
דוגמא נוספת מקורה באוסטרליה והיא הכנסת העץ קורימביה פיציפוליה (Corymbia ficifolia), כמוצר נוי חדש לשתלנים. על אף הפריחה המרהיבה וגודלו המותאם לשימוש כעץ רחוב ופוטנציאל שימוש כצמח עציץ פטיו, אין פרוטוקול ריבוי של העץ במשתלות עצי נוי בארץ. בשל השונות הרבה בזריעים, משך זמן ארוך לפריחה ואפס הצלחה בהשרשת ייחורים, מיוצרים השתילים בהרכבות. במעבדתנו החל פרויקט מחקר אשר בחן את שיטות הריבוי השונות ואיתור עצים מצטיינים בעלי פריחה צבעונית לשם הטמעת שיטת הייצור בארץ. לאחר איסוף חומר צמחי בעל פוטנציאל, נבחנו שיטות הרכבה שונות וכן כנות ורוכבים בגילאים ובמועדי הרכבה שונים על מנת לפתח פרוטוקול ריבוי קל ונח עבור השתלנים. הרכבת יתד נמצאה כיעילה ובחרנו בה כדרך מנחה (גם לשתלנים). כמקור לרוכבים נבחנו שלושה עצים בוגרים כשכל אחד פורח בצבע אחר ורוד אדום ולבן. הצלחת ההרכבה לא הראתה תלות במקור הרוכב. במהלך המחקר נבחנו שש כנות כשארבע הראו הצלחה ושתיים נכשלו. הרכבה על כנות ק. טסלריס (Corymbia tessellaris), ק.מקולטה (Corymbia maculata) וכנת מכלוא- ק. פיציפוליה Xק. קלופילה (C. Calophylla X C. ficifolia) הצליחו כמו גם ההרכבה על הכנה של קורימביה לימונית (Corymbia citriodora). למרבה ההפתעה ההרכבה על זריעים של ק. פיציפוליה עצמה נכשלו כמו גם על כנה מהאקליפטוס הכדורי. מכיוון שקורימביה ואיקליפטוס אינם בני אותו סוג ניתן להבין למה נכשלה ההרכבה על כנות איקליפטוס כדורי. הכשלון של ההרכבה על נבטים של אותו מין קורימביה פיציפוליה היתה מפתיעה ונבדקת האופציה לאי התאם עצמי, תופעה שעדין לא דווחה ברכבות. העצים המורכבים שנשתלו באדמה פרחו כבר בשנה הראשונה. פרוטוקול מסודר של מיני הכנות ואופן ההרכבה נמסר לשתי משתלות.

איור מס' 8– יחורי קורימביה פיציפוליה מורכבים על כנות זריעות של קורימביה מקולטה.
A-E הדגמת הרכבת יתד. אילוסטרציה של שתי שיטות הרכבה אלכסוןF ויתד;E H- I נקודות הצלחת ההרכבה בין הרוכבים (S) לכנות (R), J. נקודת האיחוי לאחר כמה חודשים.
דוגמא נוספת לשימוש בהרכבות מהווה שלב בתרבות עץ הארגן והכנסתו כגידול מסחרי בישראל. עץ הארגן (Argania spinosa) הוא עץ הגדל במדבריות בדרום מערב מרוקו, פירותיו מספקים מזון לבע"ח ואילו מהזרע מופק שמן בעל איכות גבוהה ביותר. ואכן, הביקוש לשמן ארגן בעולם הולך וגובר. ניסיונות תרבות הארגן בישראל החלו כבר בשנות ה 80 של המאה הקודמת אך ללא הצלחה מספקת. אחת הבעיות בה נתקלו בדרך לפיתוח הארגן כגידול חקלאי היא העובדה שטרם פותחו זנים מסחריים אשר מהם ניתן להקים חלקה מסחרית מניבה וכלכלית. לשם כך ביצענו תהליך ברירת זנים ראשוני ממספר חלקות של עצים זריעים ברחבי הארץ בניסיון לאסוף את הזנים בעלי היבול הגבוה ביותר. בעיה נוספת שהתגלתה לאחר איסוף הזנים השונים הייתה שהארגן הוא עץ קשה השרשה, כך שריבוי לצורך הקמת חלקה מסחרית אחידה הוא מסובך ויקר יותר. ניצלנו את אוסף העצים המצטיינים שנבדלו בינהם בכושר ההשתרשות על מנת לבדוק האם יש קורלציה בין כושר הרגנרציה במהלך השתרשות לזה במהלך איחוי הרכבה. לבחינת יכולת איחוי ההרכבה ביצענו הרכבות הדדיות בקווים קשי וקלי השרשה ומצאנו, שבניגוד להבדל מובהק בכושר ההשתרשות, לא נמצאו הבדלים מובהקים באחוזי ההצלחה של איחוי ההרכבה (Tzeela et al., 2022). מכך ניתן להסיק שלמרות ששני התהליכים דומים מבחינת התגובה לפציעה והחיבור המחודש שנדרש בין צרורות ההובלה כנה/רוכב או ייחור/שורש, קלונים קשי השתרשות עדין לא בהכרח מאבדים את כושר איחוי ההרכבה שלהם.
מלבד השימושים המוכרים בהרכבות לטובת יצור צמחים לחקלאות, הרכבת צמחים היא כלי אשר ניתן להשתמש בו למחקר. אחד מתחומי המחקר שהתקדמו משמעותית באמצעות הרכבות היא מעבר סיגנלים בתוך הצמח, בין אם בין השורש לנוף ובין אם מעלי הצמח למריסטמה הקודקודית. גילוי ואיפיון מנגנון בקרת הפריחה בצמחים הוא אחד הדוגמאות לכך. בקרת הפריחה הוא תהליך מורכב מאוד אשר מושפע מבקרה גנטית וסביבתית, בין היתר מאורך היום. המשותף למנגנון זה בכל הצמחים הוא הורמון פלוריגן (הגן LOWERING LOCUS T (FT)) אשר מהווה את הסיגנל המרכזי לפריחה. היה ידוע במשך שנים שהשינויים באורך היום נקלטים בעלה והסיגנל להתמיינות פרחים מועבר למריסטמה הקודקודית (Lifschitz et al., 2014) אבל לא היה ידוע מה אופי הסיגנל. אחד מהניסויים שענו על השאלה ושנחשב גם לפריצת דרך בתהליך זה פורסם בשנת 2007 בעיתון Science . בניסוי זה השתמשו בהרכבה על מנת להוכיח שישנה תנועה של החלבון מהעלים של הצמח אל המריסטמה הקודקודית. החוקרים השתמשו בצמח מוטנט ft-7 שאינו מבטא את הגן ל FT כלל. הם ביטאו בעלים של צמח זה את הגן של FT מחדש אך הפעם מחובר לרצף המקודד לחלבון הפלואורסנטי green fluorescent protein GFP (FT-GFP). כאשר הרכיבו גבעול של המוטנט ft-7 על הצמח הטרנסגניFT-GFP , גילו את החלבון FT הפלואורסנטי במריסטמה הקודקודית של המוטנט אבל לא את הרנ"א שליח שלו. הצמח המורכב גם הקדים לפרוח. בכך הוכיחו באמצעות הרכבה שהאות לשינוי מיום קצר ליום ארוך שנקלט בעלים, עובר דרך תאי השיפה בתור חלבון ולא בתור רנ"א למריסטמה הקודקודית לשם אינדוקציה לפריחה (Corbesier et al., 2007).
דוגמא נוספת של פריצת דרך מחקרית באמצעות הרכבות הגיעה מתחום המיקרו רנ"א. השאלה הלא פתורה הייתה האם רנ"א קטנים small RNA – sRNA) ) אשר משמשים בבקרה על תהליכים שונים, עוברים מרחקים בצמח בצורת הפרקורסור שלהם או בצורת פיסות הרנ"א הקטנות של 22, 23, או 24 נוקלאוטידים. הקבוצה של פרופ' בולקומב הרכיבה רוכב בו בוטא הפרקורסור של GFP sRNA על כנה של מוטנט משולש dcl2,3,4 בו אין יכולת ליצור פיסות של sRNA מהפרקורסור. אנליזה של אוכלוסיות ה-sRNA בכנה גילתה נוכחות גם של GFP sRNA וגם אוכלוסיות של sRNA נוספים שהגיעו בהובלה מהרוכב ולא יכלו להיווצר בכנה. המאמר פורסם ב Science בשנת 2010 (Molnar et al., 2010).
סקירת ספרות
Aloni, B., Cohen, R., Karni, L., Aktas, H., and Edelstein, M. (2010). Hormonal signaling in rootstock–scion interactions. Scientia Horticulturae 127, 119-126.
Aloni, R. (1993). The role of cytokinin in organised differentiation of vascular tissues. Functional Plant Biology 20, 601-608.
Aloni, R. (1995). The induction of vascular tissues by auxin and cytokinin. In Plant hormones (Springer), pp. 531-546.
Arefin, S.A., Zeba, N., Solaiman, A.H., Naznin, M.T., Azad, M.O.K., Tabassum, M., and Park, C.H. (2019). Evaluation of compatibility, growth characteristics, and yield of tomato grafted on potato (‘pomato’). Horticulturae 5, 37.
Asahina, M., Azuma, K., Pitaksaringkarn, W., Yamazaki, T., Mitsuda, N., Ohme-Takagi, M., Yamaguchi, S., Kamiya, Y., Okada, K., and Nishimura, T. (2011). Spatially selective hormonal control of RAP2. 6L and ANAC071 transcription factors involved in tissue reunion in Arabidopsis. Proceedings of the National Academy of Sciences 108, 16128-16132.
Asante, A., and Barnett, J. (1997). Graft union formation in mango (Mangifera indica L.). Journal of horticultural science 72, 781-790.
Barnett, J., and Weatherhead, I. (1988). Graft formation in Sitka spruce: a scanning electron microscope study. Annals of Botany 61, 581-587.
Baron, D., Amaro, A.C.E., Pina, A., and Ferreira, G. (2019). An overview of grafting re-establishment in woody fruit species. Scientia horticulturae 243, 84-91.
Ben-Ya′acov, A., and Zilberstaine, M. (1999). Clonal avocado (Persea americana Mili.) rootstocks in Israel. Revista Chapingo Sene Horticultura, 39-42.
Bie, Z., Nawaz, M.A., Huang, Y., Lee, J.-M., and Colla, G. (2017). Introduction of vegetable grafting. Vegetable Grafting: Principles and Practices. Wallingford, UK: CABI Publishing, 1-21.
Birkenmeier, G.F., and Ryan, C.A. (1998). Wound signaling in tomato plants: evidence that ABA is not a primary signal for defense gene activation. Plant Physiology 117, 687-693.
Björklund, S., Antti, H., Uddestrand, I., Moritz, T., and Sundberg, B. (2007). Cross‐talk between gibberellin and auxin in development of Populus wood: gibberellin stimulates polar auxin transport and has a common transcriptome with auxin. The Plant Journal 52, 499-511.
Brokaw, W.H. (1975). Rootrot resistant avocado clonal rootstocks. Plant Prop. 21, 7-8.
Buckeridge, M.S. (2010). Seed cell wall storage polysaccharides: models to understand cell wall biosynthesis and degradation. Plant physiology 154, 1017-1023.
Chawla, R., and DeMason, D.A. (2004). Molecular expression of PsPIN1, a putative auxin efflux carrier gene from pea (Pisum sativum L.). Plant Growth Regulation 44, 1-14.
Chen, Z., Zhao, J., Hu, F., Qin, Y., Wang, X., and Hu, G. (2017). Transcriptome changes between compatible and incompatible graft combination of Litchi chinensis by digital gene expression profile. Scientific reports 7, 1-12.
Cookson, S., Clemente Moreno, M., Hevin, C., Nyamba Mendome, L., Delrot, S., Magnin, N., Trossat-Magnin, C., and Ollat, N. (2014). Heterografting with nonself rootstocks induces genes involved in stress responses at the graft interface when compared with autografted controls. Journal of experimental botany 65, 2473-2481.
Cookson, S.J., Clemente Moreno, M.J., Hevin, C., Nyamba Mendome, L.Z., Delrot, S., Trossat-Magnin, C., and Ollat, N. (2013). Graft union formation in grapevine induces transcriptional changes related to cell wall modification, wounding, hormone signalling, and secondary metabolism. Journal of experimental botany 64, 2997-3008.
Corbesier, L., Vincent, C., Jang, S., Fornara, F., Fan, Q., Searle, I., Giakountis, A., Farrona, S., Gissot, L., Turnbull, C., and Coupland, G. (2007). FT Protein Movement Contributes to Long-Distance Signaling in Floral Induction of <i>Arabidopsis</i>. Science (New York, N.Y.) 316, 1030-1033.
Dayan, J., Voronin, N., Gong, F., Sun, T.-p., Hedden, P., Fromm, H., and Aloni, R. (2012). Leaf-induced gibberellin signaling is essential for internode elongation, cambial activity, and fiber differentiation in tobacco stems. The Plant Cell 24, 66-79.
del Carmen Gijón, M., Gimenez, C., Perez-López, D., Guerrero, J., Couceiro, J.F., and Moriana, A. (2010). Rootstock influences the response of pistachio (Pistacia vera L. cv. Kerman) to water stress and rehydration. Scientia Horticulturae 125, 666-671.
Dogra, K., Kour, K., Kumar, R., Bakshi, P., and Kumar, V. (2018). Graft-incompatibility in horticultural crops. International Journal of Current Microbiology and Applied Sciences 7, 1805-1820.
Duman, Z., Hadas-Brandwein, G., Eliyahu, A., Eduard, B., Abu-Abied, M., Y., Y., Faigenboim, A., Amnon, L., Irihimovitch, V., and sadot, E. (2020). Short de-etiolating increases the rooting of VC 801 avocado rootstock. Plants submitted.
Ernst, A., and Holtzhausen, L. (1978). New promising technique for rooting difficult to root avocado (Persea americana Mill.) cuttings. Citrus and sub-tropical fruit journal.
Errea, P., Felipe, A., and Herrero, M. (1994). Graft establishment between compatible and incompatible Prunus spp. Journal of Experimental Botany 45, 393-401.
Errea, P., Garay, L., and Marín, J.A. (2001). Early detection of graft incompatibility in apricot (Prunus armeniaca) using in vitro techniques. Physiologia Plantarum 112, 135-141.
Flaishman, M.A., Loginovsky, K., Golobowich, S., and Lev-Yadun, S. (2008). Arabidopsis thaliana as a model system for graft union development in homografts and heterografts. Journal of Plant Growth Regulation 27, 231-239.
Frey, C., Acebes, J.L., Encina, A., and Álvarez, R. (2020). Histological changes associated with the graft union development in tomato. Plants 9, 1479.
Frolich, E.F., and Platt, R.G. (1972). Use of the etiolation technique in rooting avocado cuttings. California Avocado Society 1971-72 Yearbook 55, 97-109.
Gandonou, C., Errabii, T., Abrini, J., Idaomar, M., Chibi, F., and Senhaji, S. (2005). Effect of genotype on callus induction and plant regeneration from leaf explants of sugarcane (Saccharum sp.). African Journal of Biotechnology 4.
Garner, R.J. (2013). The grafter's handbook. (Chelsea Green Publishing).
Ghosh, S., and Bera, B. (2015). Studies on standardization of propagation methods of some minor fruit crops in India. International Journal of Minor Fruits, Medicinal and Aromatic Plants 1, 31-36.
Goldschmidt, E.E. (2014). Plant grafting: new mechanisms, evolutionary implications. Frontiers in plant science 5, 727.
Goren, M. (1982). Approaches to the production of avocado cuttings with etiolated bases, and the endogenous changes involved in the rooting process. Thesis submitted to the Faculty of Agriculture of the Hebrew University of Jerusalem for the degree of Master of Sciences in Agriculture. .
Hadas-Brandwein, G. (2021). Cellular and molecular mechanisms underlying graft unification between the scion and a vegetative rootstock of Avocado (Persea Americana). M.Sc. Thesis, Submitted to the Robert H. Smith Faculty of Agriculture, Food & Environment, The Department of Horticulture – Research Master’s Track, The Hebrew University of Jerusalem, For the Degree ‘Master of Sciences’.
Hartmann, H.T., Kester, D.E., and Davies, F.T. (1990). Plant Propagation: Principles and Practices. (Englewood Cliffs (NJ): Prentice-Hall International, Inc.).
Hartmann, H.T., Kester, D.E., Davies, F.T.J., and Geneve, R.L. (2011). Hartmann and Kesterメs Plant Propagation. Principles and Practices. Eighth Edition. Pearson Education Limited, Essex, Great Britain.
Huang, Y., Zhao, L., Kong, Q., Cheng, F., Niu, M., Xie, J., Muhammad Azher, N., and Bie, Z. (2016). Comprehensive Mineral Nutrition Analysis of Watermelon Grafted onto Two Different Rootstocks. Horticultural Plant Journal 2, 105-113.
Hudina, M., Orazem, P., Jakopic, J., and Stampar, F. (2014). The phenolic content and its involvement in the graft incompatibility process of various pear rootstocks (Pyrus communis L.). Journal of plant physiology 171, 76-84.
Ikeuchi, M., Sugimoto, K., and Iwase, A. (2013). Plant callus: mechanisms of induction and repression. The plant cell 25, 3159-3173.
Ikeuchi, M., Favero, D.S., Sakamoto, Y., Iwase, A., Coleman, D., Rymen, B., and Sugimoto, K. (2019). Molecular Mechanisms of Plant Regeneration. Annual review of plant biology 70, 377-406.
Iwase, A., Mitsuda, N., Koyama, T., Hiratsu, K., Kojima, M., Arai, T., Inoue, Y., Seki, M., Sakakibara, H., and Sugimoto, K. (2011). The AP2/ERF transcription factor WIND1 controls cell dedifferentiation in Arabidopsis. Current Biology 21, 508-514.
Jeffree, C., and Yeoman, M. (1983). Development of intercellular connections between opposing cells in a graft union. New Phytologist 93, 491-509.
Johkan, M., Mitukuri, K., Yamasaki, S., Mori, G., and Oda, M. (2009). Causes of defoliation and low survival rate of grafted sweet pepper plants. Scientia Horticulturae 119, 103-107.
Kawaguchi, M., Taji, A., Backhouse, D., and Oda, M. (2008). Anatomy and physiology of graft incompatibility in solanaceous plants. The Journal of Horticultural Science and Biotechnology 83, 581-588.
Kawakatsu, Y., Sawai, Y., Kurotani, K.-i., Shiratake, K., and Notaguchi, M. (2020). An in vitro grafting method to quantify mechanical forces of adhering tissues. Plant Biotechnology 37, 451-458.
Köse, C., and Güleryüz, M. (2006). Effects of auxins and cytokinins on graft union of grapevine (Vitis vinifera). New Zealand journal of crop and horticultural science 34, 145-150.
Kumar, R.S., Gao, L.X., Yuan, H.W., Xu, D.B., Liang, Z., Tao, S.C., Guo, W.B., Yan, D.L., Zheng, B.S., and Edqvist, J. (2018). Auxin enhances grafting success in Carya cathayensis (Chinese hickory). Planta 247, 761-772.
Lee, J.-M. (1994). Cultivation of grafted vegetables I. Current status, grafting methods, and benefits. HortScience 29, 235-239.
Lifschitz, E., Ayre, B.G., and Eshed, Y. (2014). Florigen and anti-florigen – a systemic mechanism for coordinating growth and termination in flowering plants. Frontiers in plant science 5.
Lintilhac, P.M., and Vesecky, T.B. (1984). Stress-induced alignment of division plane in plant tissues grown in vitro. Nature 307, 363-364.
Louveaux, M., Julien, J.-D., Mirabet, V., Boudaoud, A., and Hamant, O. (2016). Cell division plane orientation based on tensile stress in Arabidopsis thaliana. Proceedings of the National Academy of Sciences 113, E4294-E4303.
Lucas, W.J., Groover, A., Lichtenberger, R., Furuta, K., Yadav, S.R., Helariutta, Y., He, X.Q., Fukuda, H., Kang, J., and Brady, S.M. (2013). The plant vascular system: evolution, development and functions f. Journal of integrative plant biology 55, 294-388.
Mason, M.G., Mathews, D.E., Argyros, D.A., Maxwell, B.B., Kieber, J.J., Alonso, J.M., Ecker, J.R., and Schaller, G.E. (2005). Multiple type-B response regulators mediate cytokinin signal transduction in Arabidopsis. The Plant Cell 17, 3007-3018.
Matsuoka, K., Sugawara, E., Aoki, R., Takuma, K., Terao-Morita, M., Satoh, S., and Asahina, M. (2016). Differential Cellular Control by Cotyledon-Derived Phytohormones Involved in Graft Reunion of Arabidopsis Hypocotyls. Plant and Cell Physiology 57, 2620-2631.
Mazri, M., Belkoura, I., Pliego-Alfaro, F., and Belkoura, M. (2010). Embryogenic capacity of embryo-derived explants from different olive cultivars. In XXVIII International Horticultural Congress on Science and Horticulture for People (IHC2010): International Symposium on 929, pp. 397-403.
Mazur, E., Benková, E., and Friml, J. (2016). Vascular cambium regeneration and vessel formation in wounded inflorescence stems of Arabidopsis. Scientific reports 6, 1-15.
Melnyk, C.W. (2017a). Connecting the plant vasculature to friend or foe. New Phytologist 213, 1611-1617.
Melnyk, C.W. (2017b). Plant grafting: insights into tissue regeneration. Regeneration 4, 3-14.
Melnyk, C.W., Schuster, C., Leyser, O., and Meyerowitz, E.M. (2015). A developmental framework for graft formation and vascular reconnection in Arabidopsis thaliana. Current Biology 25, 1306-1318.
Melnyk, C.W., Gabel, A., Hardcastle, T.J., Robinson, S., Miyashima, S., Grosse, I., and Meyerowitz, E.M. (2018). Transcriptome dynamics at Arabidopsis graft junctions reveal an intertissue recognition mechanism that activates vascular regeneration. Proceedings of the National Academy of Sciences 115, E2447-E2456.
Molnar, A., Melnyk, C.W., Bassett, A., Hardcastle, T.J., Dunn, R., and Baulcombe, D.C. (2010). Small silencing RNAs in plants are mobile and direct epigenetic modification in recipient cells. Science (New York, N.Y.) 328, 872-875.
Moore, R. (1984a). A model for graft compatibility‐incompatibility in higher plants. American Journal of Botany 71, 752-758.
Moore, R. (1984b). A Model for Graft Compatibility-Incompatibility in Higher Plants. American journal of botany 71, 752-758.
Muzik, T.J. (1958). Role of parenchyma cells in graft union in Vanilla orchid. Science 127, 82-82.
Nanda, A.K., and Melnyk, C.W. (2018). The role of plant hormones during grafting. Journal of plant research 131, 49-58.
Nanda, K., and Anand, V. (1970). Seasonal changes in auxin effects on rooting of stem cuttings of Populus nigra and its relationship with mobilization of starch. Physiologia Plantarum 23, 99-107.
Nguyen, V.-H., and Yen, C.-R. (2018). Rootstock age and grafting season affect graft success and plant growth of papaya (Carica papaya L.) in greenhouse. Chilean journal of agricultural research 78, 59-67.
Nieminen, K., Blomster, T., Helariutta, Y., and Mähönen, A.P. (2015). Vascular cambium development. The Arabidopsis book/American Society of Plant Biologists 13.
Nishikubo, N., Takahashi, J., Roos, A.A., Derba-Maceluch, M., Piens, K., Brumer, H., Teeri, T.T., Stålbrand, H., and Mellerowicz, E.J. (2011). Xyloglucan endo-transglycosylase-mediated xyloglucan rearrangements in developing wood of hybrid aspen. Plant Physiology 155, 399-413.
Nishitani, C., Demura, T., and Fukuda, H. (2002). Analysis of early processes in wound-induced vascular regeneration using TED3 and ZeHB3 as molecular markers. Plant and Cell Physiology 43, 79-90.
Notaguchi, M., Higashiyama, T., and Suzuki, T. (2015). Identification of mRNAs that move over long distances using an RNA-Seq analysis of Arabidopsis/Nicotiana benthamiana heterografts. Plant and Cell Physiology 56, 311-321.
Notaguchi, M., Kurotani, K.-i., Sato, Y., Tabata, R., Kawakatsu, Y., Okayasu, K., Sawai, Y., Okada, R., Asahina, M., and Ichihashi, Y. (2020). Cell-cell adhesion in plant grafting is facilitated by β-1, 4-glucanases. Science 369, 698-702.
Oh, S., Park, S., and Han, K.-H. (2003). Transcriptional regulation of secondary growth in Arabidopsis thaliana. Journal of experimental botany 54, 2709-2722.
Pina, A., Errea, P., and Martens, H.J. (2012a). Graft union formation and cell-to-cell communication via plasmodesmata in compatible and incompatible stem unions of Prunus spp. Scientia Horticulturae 143, 144-150.
Pina, A., Zhebentyayeva, T., Errea, P., and Abbott, A. (2012b). Isolation and molecular characterization of cinnamate 4-hydroxylase from apricot and plum. Biologia plantarum 56, 441-450.
Qiu, L., Jiang, B., Fang, J., Shen, Y., Fang, Z., Rm, S.K., Yi, K., Shen, C., Yan, D., and Zheng, B. (2016). Analysis of transcriptome in hickory (Carya cathayensis), and uncover the dynamics in the hormonal signaling pathway during graft process. BMC genomics 17, 1-13.
Ragni, L., Nieminen, K., Pacheco-Villalobos, D., Sibout, R., Schwechheimer, C., and Hardtke, C.S. (2011). Mobile gibberellin directly stimulates Arabidopsis hypocotyl xylem expansion. The Plant Cell 23, 1322-1336.
Rasool, A., Mansoor, S., Bhat, K.M., Hassan, G.I., Baba, T.R., Alyemeni, M.N., Alsahli, A.A., El-Serehy, H.A., Paray, B.A., and Ahmad, P. (2020). Mechanisms Underlying Graft Union Formation and Rootstock Scion Interaction in Horticultural Plants. Frontiers in Plant Science 11.
Reig, G., Zarrouk, O., i Forcada, C.F., and Moreno, M.Á. (2018). Anatomical graft compatibility study between apricot cultivars and different plum based rootstocks. Scientia Horticulturae 237, 67-73.
Salik, M.R., Khan, M.N., Ahmad, S., and Azhar, M. (2015). Grafting time affects scion growth in Sweet Orange under arid Environment. life 13, 58-61.
Sass, J.E. (1932). Formation of callus knots on apple grafts as related to the histology of the graft union. Botanical Gazette 94, 364-380.
Sauer, M., Balla, J., Luschnig, C., Wiśniewska, J., Reinöhl, V., Friml, J., and Benková, E. (2006). Canalization of auxin flow by Aux/IAA-ARF-dependent feedback regulation of PIN polarity. Genes & development 20, 2902-2911.
Sharma, A., and Zheng, B. (2019). Molecular responses during plant grafting and its regulation by auxins, cytokinins, and gibberellins. Biomolecules 9, 397.
Shehata, S., and El-Shraiy, A.M. (2010). Regulating cucumber grafting by interactions of cytokinins in xylem exudates of rootstock and basipetol polar auxin transport of scion at graft union. Australian Journal of Basic and Applied Sciences 4, 6179-6184.
Shimomura, T., and Fuzihara, K. (1977). Physiological study of graft union formation in cactus. Journal of the Japanese Society for Horticultural Science 45, 397-406.
Souza, L.S., Diniz, R.P., de Jesus Neves, R., Alves, A.A.C., and de Oliveira, E.J. (2018). Grafting as a strategy to increase flowering of cassava. Scientia horticulturae 240, 544-551.
Spicer, R., and Groover, A. (2010). Evolution of development of vascular cambia and secondary growth. New Phytologist 186, 577-592.
Teale, W.D., Paponov, I.A., and Palme, K. (2006). Auxin in action: signalling, transport and the control of plant growth and development. Nature reviews Molecular cell biology 7, 847-859.
Tzeela, P., Yechezkel, S., Serero, O., Eliyahu, A., Sherf, S., Manni, Y., Doron-Faigenboim, A., Carmelli-Weissberg, M., Shaya, F., Dwivedi, V., and Sadot, E. (2022). Comparing adventitious root-formation and graft-unification abilities in clones of Argania spinosa. Frontiers in plant science 13, 1002703.
Wang, Y. (2011). Plant grafting and its application in biological research. Chinese science bulletin 56, 3511-3517.
Yin, H., Yan, B., Sun, J., Jia, P., Zhang, Z., Yan, X., Chai, J., Ren, Z., Zheng, G., and Liu, H. (2012). Graft-union development: a delicate process that involves cell–cell communication between scion and stock for local auxin accumulation. Journal of experimental botany 63, 4219-4232.
Zenoni, S., Reale, L., Tornielli, G.B., Lanfaloni, L., Porceddu, A., Ferrarini, A., Moretti, C., Zamboni, A., Speghini, A., and Ferranti, F. (2004). Downregulation of the Petunia hybrida α-expansin gene PhEXP1 reduces the amount of crystalline cellulose in cell walls and leads to phenotypic changes in petal limbs. The Plant Cell 16, 295-308.


